WB 是一种相对、半定量的检测方式。
WB 的各种 buffer
- Sample buffer 指的是双向电泳样品缓冲液,样品的特征:复杂,含盐或其他污染物,易被蛋白酶降解,动态范围宽(>X106),溶解性不均一(疏水性/亲水性),分子量、等电点的范围宽(10-500KDa,pH2-14)。
- Loading buffer 指的是上样缓冲液,也就是样品中加的缓冲液,是一种用于 DNA 电泳试验的缓冲液。
- 裂解缓冲液:见蛋白样本的制备
蛋白样本的制备
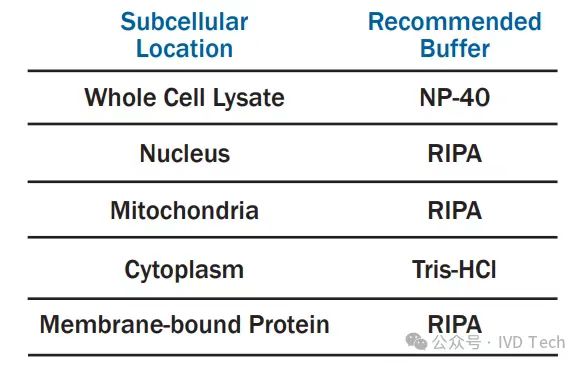
裂解缓冲液的选择
根据样本的类型选择合适的裂解液。
- 5x 的 sample buffer 与样品 1:4(即总体系里 sample buffer 为 1x)(如样品 40 μl + sample buffer 10 μl)混匀。
- 金属浴 95°C 10 min,之后剩余样品可以 -20°C 保存数月(或 -80°C 更长时间保存)
- BCA 蛋白定量:(振荡 + 吸光度(562 nm))三组
电泳
SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE):若蛋白质样品和聚丙烯酰胺凝胶系统中加入带负电荷较多的十二烷基硫酸钠(SDS),使所有蛋白质颗粒表面覆盖一层 SDS 分子,掩盖蛋白质原有电荷的影响,此时蛋白质在电场中的泳动速率仅与蛋白质颗粒大小有关。
由于分子筛效应,在聚丙烯酰胺凝胶中电泳,肽链越长,迁移速度越慢,分子量的对数与蛋白质肽链的迁移率之间有线性关系。
当蛋白质的分子量在 15000–200000 之间时,电泳迁移率与分子量的对数值呈线性,符合下列方程:
$$\lg(Mr) = K - b \times mR \,.$$式中:Mr 为蛋白质的分子量;K 为常数;b 为斜率;mR 为相对迁移率。在条件一定时,b 和 K 均为常数。
器材和试剂准备
- 器材:配胶架、玻璃板、10 ml 离心管(配胶用)、移液枪和枪头、冰盒(放低温试剂)。
- 玻璃洗干净,吹风机吹干,朝一个方向吹。
- 底部对齐,薄玻璃板先放。
- 试剂:SDS-PAGE 常温试剂、SDS-PAGE 低温试剂、dd 水、无水乙醇
配胶
- 分离胶:
- 分离胶的酶和 TEMED 可以加到 1.5–2 倍的用量,加速凝固。
- 加 TEMED 之前混匀。
- 配胶加到绿条以下 5mm,加完之后加蒸馏水(或者无水乙醇,不容易相溶)压胶。
- 压缩胶:
- 注意 Tris 的 pH,浓缩胶和分离胶不一样。
- 加 TEMED 之前混匀。
- 浓缩胶加到溢出,插齿梳时降齿梳下缘于玻璃板上缘相贴,水平插入。
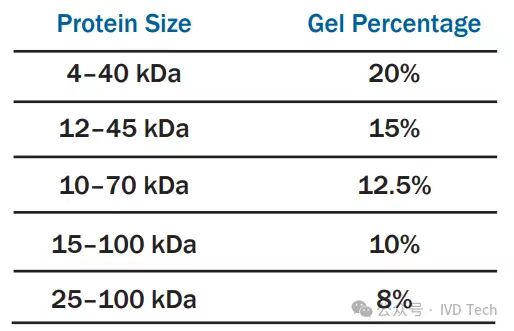
分离胶浓度的选择
根据目的蛋白分子量确定胶的浓度。
选择合适的移液枪量程。移液枪在量程 30%–100% 的范围内时比较准。
电泳
WB 配液
- 电泳液:一瓶粉末(?),加 1L 蒸馏水
- 电转液:Glycine 28.8 g,Tris 6.06 g,先加 1600 ml 蒸馏水磁转子混匀溶解,加 400 ml 甲醇,混匀后尽快装入玻璃瓶,4°C 预冷)
- (齿梳一定要在电泳液里拔)安装凝胶(凝胶 + 齿梳 + 两块玻璃板),加新电泳液(这里面的不能回收),拔齿梳
- 计算:按 BCA 蛋白定量计算蛋白量,按 8-10 ug 计算体积(小离心去除瓶盖冷凝水珠)
- 上样:每组 n > 3,组间加一列 marker,首尾各加一列 marker,并在首部额外多加一列 marker(或者只加一列 marker,但量加倍)
- 组装 WB 仪器,外层加电泳液到 2Gles(可用回收的电泳液)。
- 开始跑,70V 30min(压缩胶),之后 110V(分离胶),1h 内大概会跑完,观察溴酚蓝以确认。
转膜
将分离的蛋白质从 SDS-PAGE 凝胶转印至硝酸纤维素(NC)膜(我们实验室用)、聚偏乙烯氟化物(PVDF)膜等固相膜上是 Western Blot 成败的关键。
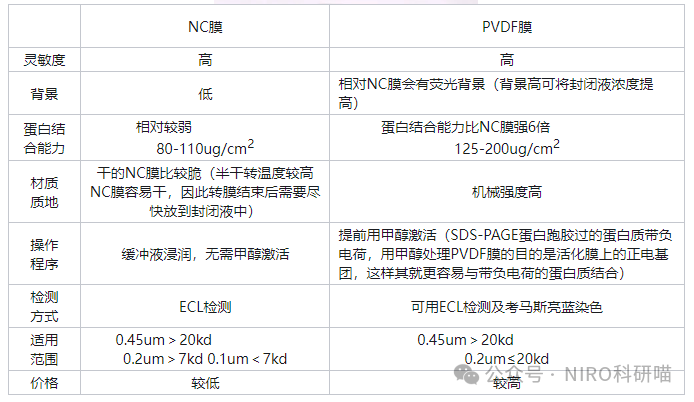
电转膜对比
- 电转液浸泡滤纸等。
- 取胶,用刮刀去除压缩胶以及底部溴酚蓝以下部分。
- 三明治:在电转液中组装滤纸-胶-膜(裁剪电转膜到合适大小,使用转膜缓冲液充分润湿膜表面),用刮刀贴紧,避免气泡。
- 再组装黑板-海绵-滤纸-胶-膜滤-纸-白(透明)板,夹紧。
- 外层电转液加到 4 Gles,260 mA,90 min。
PVDF 膜的预处理
- 将切好的 PVDF 膜与滤纸放入甲醇中浸泡 10 秒(浸泡时间可根据实验条件进行适当调整),这一步是为了增加 PVDF 膜的润湿性和亲水性,因为 PVDF 膜本身是疏水性的。
- 随后将 PVDF 膜移至电转缓冲液中浸泡至少 10 分钟(去除甲醇残留),以确保膜在转膜过程中能保持良好的导电性和吸附性。
甲醇浸泡和转膜缓冲液清洗,能够提高膜表面的活性,增强与蛋白质之间的结合,从而确保实验的准确性和成功率。
膜孔径的选择
- 大于 20KD → 孔径 0.45 μm 的膜
- 小于 20KD → 孔径 0.2 μm 的膜
封闭
封闭液中的蛋白可以与固相载体表面的空白位置结合,同样以机械填补(堆积)和吸附覆盖的方式结合在膜上,因为有填补和覆盖蛋白结合位点以避免一抗的非特异性结合,所以有“封闭”的说法。
常用的封闭剂有 5% 脱脂奶粉、5%BSA、血清和明胶等。
无脂牛奶室温孵育 1h。
孵育抗体
- 裁模(左上剪一角):根据大致分子量裁剪一定竖直范围的膜,每条膜的水平方向要包括部分 marker。
- 一抗 4°C 摇床孵育过夜(也可室温孵育 1 小时,但在 4°C 孵育过夜通常可增加信号强度并减少背景信号)(一抗二抗都可以回收(-20°C))(孵育时两条放在一起时,背靠背,以使条带与一抗充分接触)
- TBST(TBS 固体 + 2L dd 水 + 2 ml Tween 20)洗涤摇床 60,5 min,三次(TBST 量稍微多一点)
- 二抗约 4 ml/格,摇床孵育 1h
一抗和二抗
- 一抗识别目标蛋白
- 二抗可识别一抗并被过氧化物酶标记,可进行荧光反应(或同位素标记)
显影
显影液 1:1 配成工作液,4 张片 1 ml 总量足够。